질산염

| “ | 식물에게는 비료, 동물에게는 독극물 | ” |
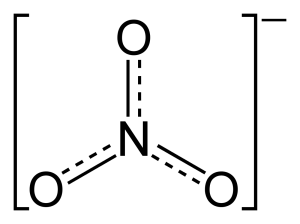
질산염(영어: nitrate)은 분자구조식 NO3−의 다원자성 이온이다. 분자량은 62.0049g/mol이다
존재하는 곳[편집]
질산염은 자연 상태의 흙에 많은 양이 존재하는데, 주로 칠레초석(NaNO3)이라는 광물의 형태로 발견된다.
다양한 종류의 질화세균은 질산염을 생산할 수 있다. 질산염은 화약의 주원료이다. 이와 관련하여 고려 시대에 최무선은 화약을 만들기 위해 집의 마룻바닥 밑에서 흙을 긁어모은 뒤, 이 흙에서 질산염을 추출하여 화약을 제조하였다는 기록이 있다. 질산염은 오줌과 분변이 발효되는 과정에서 생성된다.
용도[편집]
오늘날 질산염의 가장 주된 용도는 농업에 사용되는 비료이다. 질산염은 물에 잘 녹을 뿐만 아니라 식물이 이용하기 좋은 형태이기 때문이다. 매년 수백만kg의 질산염이 이 목적으로 공업적으로 생산되고 있다.
그 밖에 화약 제조와 유리 제조에도 사용되고 있다.
독성[편집]
동물이 섭취한 질산염(NO3−)의 일부는 체내에서 아질산염(NO2−)으로 환원된다. 이후 혈류로 흡수된 아질산염은 헤모글로빈에 있는 Fe2+ 상태의 철 이온을 Fe3+으로 산화시킨다. Fe3+ 상태의 철 이온을 가진 헤모글로빈은 더 이상 산소와 결합할 수 없게 된다. 결과적으로 적혈구가 산소를 운반할 수 없게 되므로 조직에서는 심각한 산소 결핍증이 나타난다. 이러한 상태를 메트헤모글로빈혈증이라고 한다. 체내의 아질산염(NO2−)은 저절로 암모니아(NH3) 형태로 전환되므로 치료를 하지 않더라도 스스로 회복된다. 하지만 이 과정은 비교적 느리게 일어나므로, 아질산염의 농도가 아주 높은 경우에는 치명적일 수 있다.
인간에서의 위험성[편집]
인간 역시도 질산염 중독에 걸릴 수 있다. 메트헤모글로빈혈증이 일어나면 조직으로의 산소공급이 되지 않으므로 피부가 파랗게 변하는데, 이를 청색증이라고 한다. 특히 아질산염을 대사하는 능력이 떨어지는 신생아가 메트헤모글로빈혈증에 취약하다. 한 때에는 신생아에서 메트헤모글로빈혈증이 나타나는 이유는 신생아가 질산염이 다량 함유된 물을 마셨기 때문이라고 했었는데, 현재는 질산염 과다섭취 외에도 다른 다양한 원인이 있는 것으로 생각된다. 일부 채소는 고농도의 질산염이 포함되어 있는데, 이 또한 질산염 중독의 원인이 될 수 있다. 특히 양상추 같은 채소가 햇볕을 충분히 쬐지 못하는 경우가 위험하다. 채소를 재배할 때 질산염 비료를 너무 많이 사용하는 경우에도 위험할 수 있다.
신생아를 제외한 일반인은 크게 걱정할 필요는 없으나, 위산이 제대로 분비되지 않는 사람이나 채식주의자는 질산염 중독을 조심해야 한다.
메트헤모글로빈혈증은 메틸렌블루를 주사하여 치료 가능하다.