효소
효소(한자: 酵素, 영어: enzyme)는 세포 안에서 촉매로 작용하는 단백질 분자이다. 효소는 체내에서 일어나는 화학반응의 속도를 빠르게 하는 기능을 하지만, 이 과정에서 효소는 반응물과는 달리 소모되지 않아 무한 재사용이 가능하다. 생물체 내에서 일어나는 거의 모든 생화학반응은 효소의 작용이 동반된다. 충분한 양의 효소가 있어야 화학 반응이 충분히 빠른 속도로 일어난다. 가끔씩 음식을 많이 먹었을 때, 소화가 되지 않아 속이 더부룩한 것을 느낀 경험이 있을 것이다. 이는 바로 음식물의 양에 비해 소화 효소가 부족하기 때문에 생긴 현상이다.
화학 반응이 일어나기 전의 물질을 기질이라고 하며, 기질은 효소의 도움을 받아 화학 반응을 통해 생성물이 된다. 즉, 효소는 기질에 작용하여 기질을 생성물로 바꾼다.
어원은 '효모 속에 있다'는 뜻의 그리스어 ἔνζυμον(in yeast)로, 1877년 독일의 퀴네에 의해 이름 붙여졌다.
효소의 구조[편집]
효소는 여러개의 아미노산으로 이루어진 큰 분자이다. 아미노산은 서로 연결되어 긴 사슬을 이룬다. 이 아미노산 사슬은 다시 복잡한 구조로 접혀진다. 모든 효소에는 기질이 와서 결합할 수 있는 자리가 있다. 이런 곳은 홈, 골짜기, 결합부위 등으로 부른다.
이 세상에는 수없이 많은 효소들이 있는데, 효소는 일반적으로 기능에 따라 이름이 붙여진다. 효소의 이름은 주로 ~아제(-ase)로 끝난다. 예를들면 침에서 탄수화물을 분해하는 효소는 아밀라아제, 위액에서 단백질을 분해하는 효소는 펩티다아제, 간이나 감자등에 들어 있는 과산화수소를 분해하는 효소는 카탈라아제라고 한다. 이처럼 큰 화합물을 여러개의 작은 화합물로 분해하는 효소도 있지만, 반대로 여러개의 작은 화합물을 큰 화합물로 합성하는 효소들도 있으며, 그 외에도 여러가지 형태의 화학 반응을 모두 도와줄 수 있다. 이에 대한 개략적인 분류를 알고 싶다면 스크롤바를 내려서 아래 항목을 참고하라.
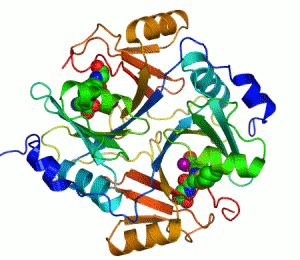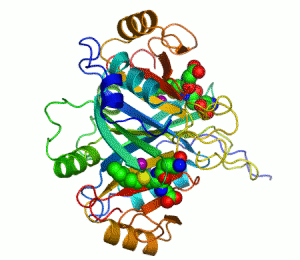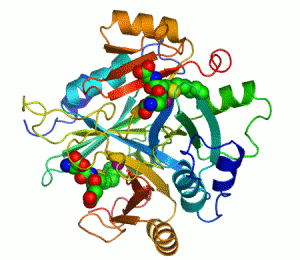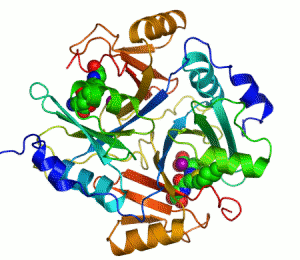
생화학자들이 효소를 그릴 때에는 리본 모형으로 나타낸다. 리본 모형으로 효소를 그리는 이유는, 효소분자가 워낙 크기도 클 뿐더러 구조도 복잡한지라, 효소분자를 이루고 있는 하나하나의 원자들을 모두 그리면 너무 골치아프기 때문이다. 리본 모형은 원자를 모두 나타내지 않고 효소의 개략적인 입체 모형만을 제공한다.
효소는 효소마다 잘 작용할 수 있는 온도와 pH가 정해져 있다. 예를 들어 사람의 경우에는 체내 온도가 항상 섭씨 36.5oC로 유지되므로 인간의 몸 속에서 작용하는 효소는 모두 이 온도에서 가장 잘 작용하도록 되어 있다. 우리가 찬 음식을 많이 먹었을 때, 배가 아픈 것도 바로 소화 효소가 제대로 작동하지 못해서이다. 우리 몸은 각 기관별로 pH가 다르다. 따라서 효소들도 작용하는 부위에 따라 가장 잘 작용할 수 있는 pH조건이 다르다. 예를 들어, 입 안의 pH는 중성(7)을 유지하기 때문에 침 아밀라아제의 최적 pH는 7이다. 반면에 위액의 pH는 1.5의 강산성 조건이므로 위에서 작용하는 소화효소인 펩티다아제의 최적 pH는 1.5이다.
어떤 화학물질들은 효소의 작용이 더욱 더 잘 되도록 만든다. 이러한 화학물질은 활성제라고 불린다. 소화가 안되서 속이 더부룩할 때 먹는 소화제는 활성제의 좋은 예이다. 반면에 어떤 화학물질들은 효소의 작용을 방해한다. 이러한 화학물질은 억제제라고 불린다. 위액이 너무 많이 나와서 속이 쓰릴 때 먹는 제산제는 억제제의 좋은 예이다. 이외에도 여러 의약품들은 효소의 작용을 활성시키거나 억제시킴으로서 작용하는 경우가 많다.
기능[편집]
효소 반응을 화학식으로 간단하게 정리하면 다음과 같다.
- 기질 + 효소 --> 기질:효소 --> 생성물:효소 --> 생성물 + 효소
예를 들어, 수크라아제라는 효소는 수크로오스(흔히 설탕이라 부르는 것)를 포도당과 과당으로 분해한다. 수크라아제의 기질 결합부위에 수크로오스(기질)가 달라붙으면, 수크라아제는 수크로오스를 이루고 있는 포도당과 과당 사이의 화학결합을 깨부순다. 그리고 나서 분해된 포도당과 과당이 수크라아제에서 떨어져 나온다.
효소의 주요 특징을 요약하면 다음과 같다.
- 효소는 촉매제이다. 효소는 반응이 일어나는 속도를 평균적으로 100억배 이상 빠르게 만든다. 하지만 효소 자신은 반응이 일어나도 변화하지 않는다.
- 적은 양으로도 효과적으로 화학 반응을 도울 수 있다. 보통 효소 한 분자는 일 분에 1000개의 분자를 반응시킬 수 있으며, 일 분에 300만개의 분자를 반응시키는 효소도 발견된 바 있다.
- 굉장히 특이적이다. 하나의 효소는 단 한 종류의 화학반응만 일으킬 수 있다.
조효소[편집]
조효소, 또는 보조인자란 효소가 작용하기 위해서 반드시 필요한 다른 분자이다. 조효소는 단백질은 아니며, 유기체일수도 있고 무기체일수도 있다. Mg2+, Cu2+, Mn2+ 같은 금속 이온이 중앙에 위치하기도 한다. 이와 같은 미량원소와 비타민은 조효소로 작용하기 때문에 반드시 일정량을 음식을 통해 섭취해야 한다.
분류[편집]
다음은 효소를 기능에 따라 크게 6가지로 분류한 것이다.
- 산화-환원효소: 전자의 이동을 수반하는 촉매제
- 교환효소: 작용기를 다른 분자로 이동시키는 효소.
- 수화효소: 기질에 -OH(하이드록시기)를 붙이는 효소.
- 분해효소: 화학 반응을 깨부수는 효소. 이중결합이나 고리구조를 만들기도 한다.
- 이성질체효소: 기질을 그 기질의 다른 이성질체로 변화시키는 효소.
- 리가아제: 다른 두 분자를 결합시키는 효소.
| 생물과 화학의 만남 - 생화학 |
|---|
